导读
中华猕猴桃(Actinidia chinensis)是世界上最受欢迎的水果之一,其品质主要是由关键代谢物(糖、类黄酮和维生素)决定。之前关于猕猴桃的研究大多是通过单一组学方法完成的,或者只涉及有限的代谢物。猕猴桃发育和成熟过程中的动态代谢组及其潜在的调控机制尚不清楚。
本研究中,我们使用高分辨率代谢组学和转录组学分析,研究了11个不同发育和成熟阶段的猕猴桃的代谢情况,揭示了515种代谢物及其共表达基因的分类,主要分为10个不同的代谢物和基因模块(MM vs GM)。通过整合生物信息学和功能基因组分析,我们构建了一个全局代谢图谱,揭示了猕猴桃生长周期中发生的所有代谢变化的转录组和转录调控网络。
除了已知的代谢物和基因模块,我们还发现了新的转录因子,可以调节原花青素、维生素C和其他重要代谢物的积累。
我们的研究结果揭示了猕猴桃的代谢调控网络,为猕猴桃品质的设计和改良提供了宝贵资源。
论文ID
原名:A comprehensive metabolic map reveals major quality regulations in red flesh kiwifruit (Actinidia chinensis)
译名:全局代谢图谱揭示红肉猕猴桃的主要品质规律
期刊:New Phytologist
IF:10.323
发表时间:2023.03
通讯作者:刘明春,张阳
通讯作者单位:四川大学
实验设计

实验结果
1. 猕猴桃代谢调控网络(KMRN)的构建
为了揭示猕猴桃的代谢动力学和相关的潜在机制,我们在11个果实发育和成熟阶段(FDRs)收集了猕猴桃的果实,包括从开花后(DPA)10天到170天(图1a)。根据不同果实发育和成熟阶段的果皮颜色的表型变化,我们将这些样本分为三个组,包括I组、II组和III组(图1a)。在10 DPA时,I组果实的果皮呈现紫色,而在25、40、55、70和85 DPA时,II组早期果实的果皮呈现深绿色,在100、115和130 DPA时,II组后期果实的果皮变为浅绿色。然而,在145和170 DPA时,完全成熟的III组果实的果皮颜色变黄(图1a)。
基于LC-MS/MS,我们对这些果皮组织进行了的代谢谱分析。在一个或多个FDRSs(数据集S1)中,我们在猕猴桃中总共鉴定和注释到693种代谢物。我们对这些果实样本进行了转录组测序。去掉低质量的reads,我们获得了约431-Gb的clean data(数据集S2)。我们使用唯一映射的mRNA的reads来计算基因的表达水平(TPM)。在11个不同FDRSs的一个或多个阶段,总共有47433个蛋白质编码基因(最大TPM>0)表达(数据集S3)。
此外,层次聚类分析(HCA)表明,每个FDRS的代谢组或转录组,在三个生物学重复中高度相关,11个FDRS样本形成了三个不同的簇(图1b,c)。主成分分析进一步证明了这种聚类(PCA,图1d,e)。在11个FDRSs中,代谢组和转录组的聚类与猕猴桃果皮颜色的表型分组是一致的(图1a)。这些结果表明,代谢物的积累与猕猴桃发育和成熟过程中的基因表达是平行的、相关的。
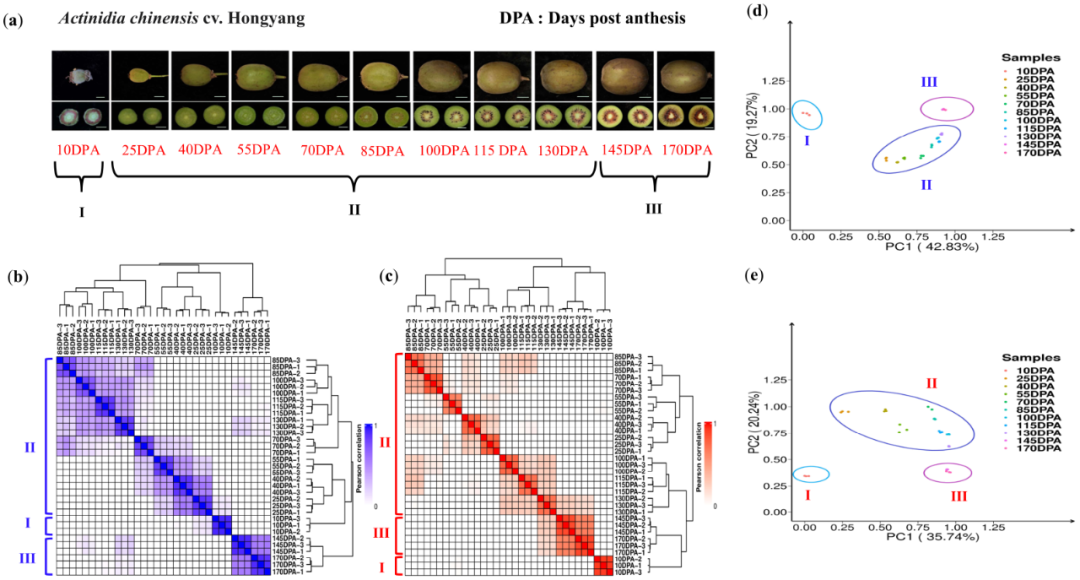
图1 代谢组学和转录组学数据集汇总。(a)猕猴桃果实在11个不同发育和成熟阶段(FDRSs)的表型变化。在开花后10、25、40、55、70、85、100、115、130、145和170天(DPA)的完整猕猴桃和切片猕猴桃。标尺=1厘米。(b,c)代谢组(b)和转录组(c)的聚类分析。色阶0-1表示皮尔逊相关性系数(PCC)。(d,e)代谢组(d)和转录组(e)的主成分分析(PCA)。根据果皮(a)、代谢组(b,d)和转录组(c,e)中的紫色、绿色和黄色表型,11个FDRSs的猕猴桃分为三大组,包括组I、组II和组III。
2. 猕猴桃发育和成熟过程中“MM vs GM”模块的建立
为了深入了解猕猴桃发育和成熟过程中的代谢情况,我们研究了猕猴桃代谢调控网络(KMRN),并用CAS数据库鉴定了515种代谢物。这些代谢物包括36种生物碱、74种氨基酸及其衍生物、60种类黄酮、64种脂质、17种木酚素和香豆素、38种核苷酸及其衍生物、57种有机酸、71种酚酸、13种丹宁酸、48种糖醇类、14种萜类、12种维生素和11种其他的未分类化合物(表S1)。基于fuzzy c-means聚类算法,我们将代谢物的累积模式生成了十个代谢模块(MMs)(图2a;数据集S4)。代谢模块I(MM-I)包含优先在10 DPA时积累的代谢物,而MM-VI中的代谢物主要在25 DPA时积累(图2a;图S1)。MM-II代表在整个FDFS中逐渐减少的代谢物。相反,MM-IX代表从10 DPA到170 DPA逐渐增加的代谢物(图2a;图S1)。在不同MM中,我们观察到代谢物的分布是不同的。例如,氨基酸及其衍生物在MM-I、MM-VI和MM-VIII中高度聚集,而糖醇类在MM-IX中高度聚集(图2c;图S1)。
为了揭示不同FDFSs中代谢物积累的遗传基础,我们使用KMRN(数据集S5)中的33371个基因(最大TPM≥1)与代谢物进行了共表达分析。基于基因表达的log2值和代谢物丰度值,我们计算了皮尔逊相关性系数(PCC)。我们发现,总共有24325个基因与代谢物(至少一种代谢物)显著相关(PCC≥0.8)。与聚类的代谢物一样,24325个基因被分为十个基因模块(GM)(数据集S6)。MM和GM表现出较高的一致性(图2a,b;图S1)。代谢物和基因模块之间的实质相似系数进一步证明了这一发现(数据集S7)。
然后,我们对十个GMs进行了KEGG分析,发现GMs中富集的代谢途径(MPs)与相应MMs中代谢物生物合成直接相关(数据集S8)。例如,GM-I中富集的MPs包括核糖体、DNA复制、嘧啶代谢和类黄酮生物合成(图2d;数据集S8),它们负责核苷酸及其衍生物、类黄酮和丹宁酸的产生,所有这些途径也聚集在MM-I中(图2c;表S1)。GM-V中富集的MPs是亚麻酸和α-亚油酸代谢(图2e;数据集S8),主要参与了MM-V中α-亚麻酸和γ-亚麻酸的积累(数据集S4)。此外,糖醇类主要聚集在MM-IX中(图2c;表S1),相应的GM-IX富集的MPs为糖酵解/糖异生、柠檬酸循环、戊糖磷酸途径、碳/丙酮酸/淀粉/蔗糖/半乳糖代谢(图2f;数据集S8)。总之,我们的数据表明,代谢的主要动力在很大程度上与猕猴桃发育和成熟过程中各个代谢途径的基因表达是平行的。
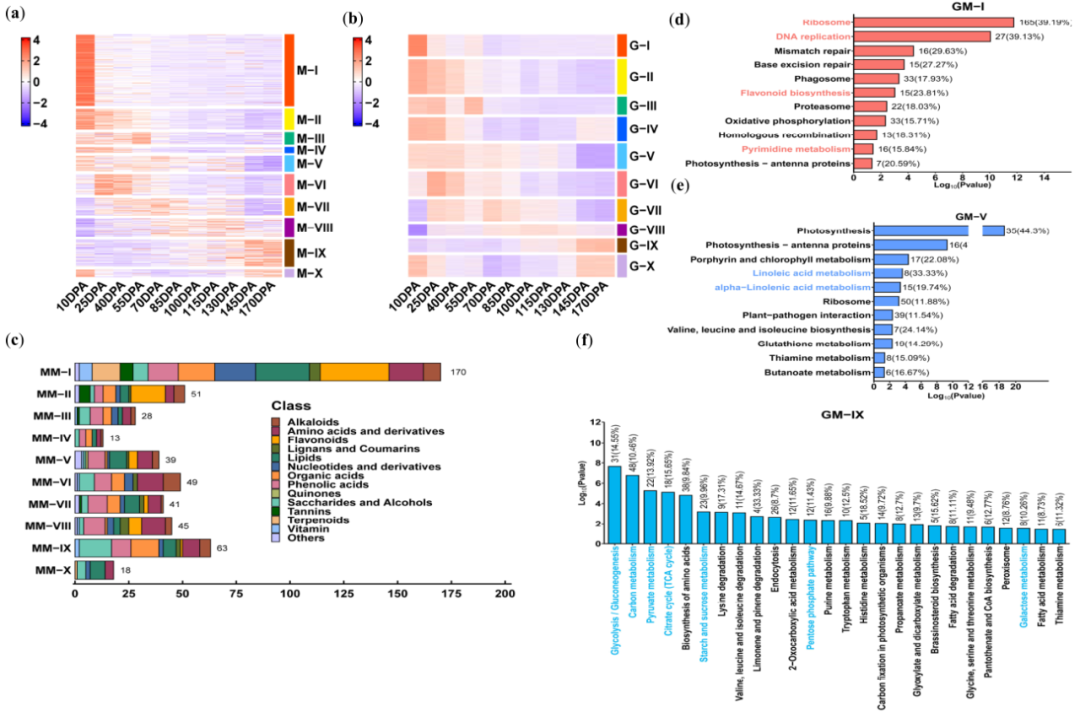
图2 猕猴桃代谢调节网络(KMRN)的构建——猕猴桃不同发育和成熟阶段主要代谢物与基因表达模式的关联分析。(a-b)代谢物模块(MMs)与基因模块(GMs)。10个MMs(MM-I–MM-X;a)中代谢物的积累模式,10个GMs(GM-I–GM-X;b)中24325个共表达基因的表达模式。数据集的Z-值被标准化为-4到4。(c)十种MMs中代谢物类别的统计。(d-f)KEGG富集分析。GM-I(d)、GM-V(e)和GM-IX(f)中共表达基因的KEGG富集分析。颜色标记#F8766D、#619CFF和#00BAF8表示代谢途径中的各种富集通路,这些通路分别对应于MM-I、MM-V和MM-IX中的代谢物。
3. 可溶性糖积累的关键调节因子
甜味是猕猴桃最重要的品质特征之一,受到消费者的关注。可溶性糖是猕猴桃甜味的主要指标,包括D-蔗糖、D-果糖、D-葡萄糖、肌醇和其他糖类。猕猴桃可溶性糖的积累主要涉及淀粉/糖代谢途径。基于该途径的KMRN,我们检测到了5种代谢物,即D-蔗糖、D-葡萄糖、D-葡萄糖-6-磷酸、D-果糖和D-果糖-6-磷酸(图3a)。其中,三种主要的可溶性糖(D-蔗糖、D-果糖和D-葡萄糖)都聚集在MM-IX中,而D-果糖-6-磷酸和D-蔗糖-6-磷酸分别聚集在MM-I和MM-X中。在145 DPA和170 DPA时,编码多种α-淀粉酶/β-淀粉酶(AMY/BAM)(6/15)和蔗糖磷酸合成酶(SPS)(3/4)的基因表达水平较高,这些基因被聚集到GM-IX中。相反,在145 DPA和170 DPA时,猕猴桃中只有己糖激酶(HK)(6/7)和果糖激酶(FK)(3/4)的基因表达水平较低(图3b;数据集S9)。此外,MM-IX中的两个BAMs基因(AcBAM3.1和AcBAM3.5)编码可溶性糖积累的关键酶。这些结果表明,与之前的研究结果一致,在后期FDRSs中,猕猴桃中可溶性糖的积累主要是淀粉降解导致的。
为了进一步鉴定与可溶性糖积累相关的关键转录因子(TFs),我们将顺式作用元件与共表达模块相结合(图3c)。使用该方法,通过建立MM-IX中代谢物与GM-IX中基因之间的密切相关性,我们构建了可溶性糖的MRN(图S2;数据集S9)。通过分析KMRN中的前10个TF家族,我们发现NAC、C2H2、AP2/ERF、MYB和bHLH(占比52.54%)可能是调节猕猴桃可溶性糖积累的TF家族(图S2)。考虑到可溶性糖积累是果实成熟的关键特征之一,我们关注了ERF-type的TFs,它们被报道过参与了乙烯介导的果实成熟过程。在可溶性糖MRN中,我们发现了AcERF182,有报道证明,它通过激活AcBAM3.5的表达来调节可溶性糖积累(图3d)。这些结果表明,本研究中建立的KMRN可以用于验证之前已报道的代谢调控途径。
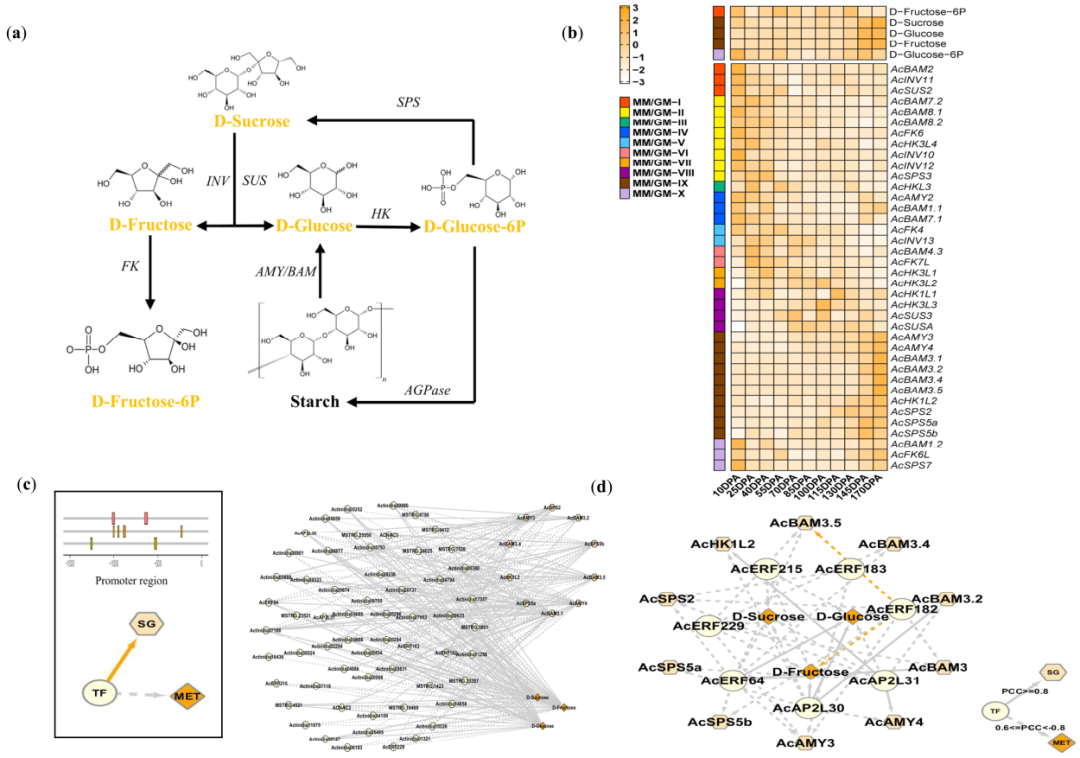
图3 KMRN的分析揭示了猕猴桃可溶性糖积累的关键调控因素。(a)可溶性糖代谢途径。在KMRN中检测到的代谢物用彩色标注(#FFA500)。AMY,α-淀粉酶;BAM,β-淀粉酶;SPS,蔗糖磷酸合成酶;AGPase,ADP葡萄糖焦磷酸化酶;INV,蔗糖转化酶;SUS,蔗糖合成酶;HK,己糖激酶;FK,果糖激酶。(b)可溶性糖代谢途径中代谢物和基因的热图。数据的Z-值标准化为-3至3。(c)MRN构建的示意图。TF:转录因子;SG:结构基因;MET:代谢物。启动子区:结构基因启动子序列的顺式作用元件。(d)可溶性糖MRN与AP2/ERF相关的子网络。已报道的调控关系用彩色虚线(#FFA500)标注。
4. 花青素积累的关键调节因子
红肉猕猴桃最重要的农业特性是具有含量较高的花青素和原花青素等(PAs)。使用KMRN,我们鉴定了13种代谢物,包括柚皮素、二氢山柰酚、二氢槲皮素、儿茶素、表儿茶素、矢车菊素-3-O-葡萄糖苷和6种与花色苷/原花色苷生物合成相关的原花青素(图4a)。这些代谢物大多聚集在MM-I/II中,但矢车菊素-3-O-葡萄糖苷(属于花青素类)聚集在MM-IX中(图4b)。与代谢物积累的模式一致,大多数花青素生物合成的相关基因聚集在GM-I/II中(21/23),例如查尔酮合酶(CHS)、黄烷酮3-羟化酶(F3H)、类黄酮3′-羟化酶(F3′H)、二氢黄酮醇还原酶(DFR)、花青素还原酶(ANR)和无色花青素还原酶(LAR)等基因(图4b)。这些结果表明,猕猴桃在发育和成熟过程中,PAs在早期形成,花青素在中后期形成,这与之前的研究一致(图S3)。
之前的研究表明,AcMYB123和AcMYB10/AcMYB75/AcMYB110能够调节花青素生物合成相关基因AcF3'H1、AcANS、AcF3GT1和AcGST1,从而调节红肉猕猴桃的花青素形成。我们的花青素生物合成基因和相关转录因子的转录组数据进一步表明,AcF3'H1、AcF3GT1、AcMYB10/AcMYB75/AcMYB110、AcMYB123聚集在同一分支上,AcF3GT1(PCC=0.82)和F3'H1(PCC=0.67)与AcMYB10/AcMYB75/AcMYB110是共表达的(图S3)。总之,在整个猕猴桃生长周期中,我们可以使用KMRN准确地验证之前已报道的代谢调控网络。
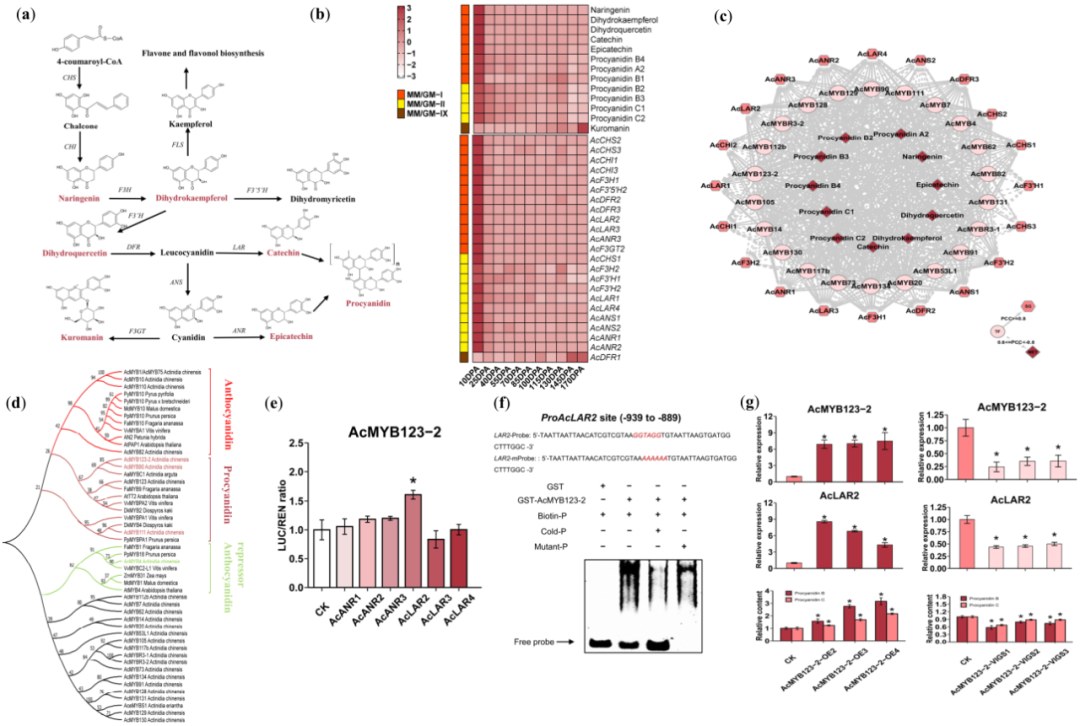
图4 转录因子AcMYB123-2通过转录调节猕猴桃中AcLAR2来调节原花青素的积累。(a)原花青素相关代谢途径。在KMRN中检测到的代谢物由颜色(#AE323F)标注。CHS,查尔酮合成酶;CHI,查尔酮异构酶;FLS,黄酮醇合成酶;F3H,黄酮-3-羟化酶;F3'5'H,类黄酮3'-5'-羟化酶;F3'H,类黄酮3'-羟化酶;DFR,二氢黄酮醇还原酶;LAR,无色花青素还原酶;ANS,花青素合成酶;ANR,花青素还原酶;F3GT,类黄酮3-O-葡萄糖基转移酶。(b)原花青素相关代谢途径中代谢物和基因的热图。数据的Z-值标准化为-3至3。(c)原花青素MRN中与MYB相关的子网络。(d)原花青素MRN中的四类MYB转录因子。系统发育树中花青素(#FF0000),原花青素(#AE323F)、花青素抑制因子相关的原花青素MRNs(#C3E49F)以及其他类。(e)转录因子AcMYB123-2对其潜在靶基因启动子活性的影响。数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。(f)AcMYB123-2与AcLAR2启动子中的Myb-p基序结合。用生物素探针标记(Biotin-p)含有Myb-p元件的野生型(WT)。用Cold-p或Myb-p突变的探针(Cold-p or Mutant-p)对AcMYB123-2 binding进行竞争。符号–和+表示探针和GST-标记的AcMYB123-2蛋白的缺失或存在。(g)基因功能测定。AcMYB123-2过表达或沉默的猕猴桃中AcMYB123-2和AcLAR2的相对mRNA水平,以及原花青素B和原花青素C的相对含量。数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。
5. 调节原花青素代谢的新转录因子
与花青素代谢的研究不同,猕猴桃中与原花青素(PA)代谢相关的MM和GM在很大程度上仍然未知。为了解决这个问题,我们使用了与可溶性糖的相同的研究策略(图3c)。通过建立MM-I/II中代谢物与GM-I/II中基因之间的紧密相关性,我们构建了原花青素MRN(图S4;数据集S10)。该网络的详细分析,进一步表明了前4个TF家族中的bHLH、MYB、MYB-related和AP2/ERF可能调节了猕猴桃中的PA代谢(图S4)。
bHLH、MYB和MYB-related家族中的TFs,已经报道过可以调节拟南芥、水稻和其他植物中的PA代谢。MYB、bHLH和WD蛋白可以形成MYB-bHLH-WD40(MBW)复合物来调节PA代谢相关基因的表达,MYB可以与靶基因启动子结合来激活或抑制其表达。基于这些结果,我们在原花青素MRN中选择并筛选了MYB相关的子网络(图4c)。系统发育分析表明,MYB家族中的候选基因AcMYB90、AcMYB111和AcMYB123-2(图4d),与AtTT2和VvMYBPA2是同源基因,它们分别参与了拟南芥和葡萄中的PA代谢。据预测,这些基因在猕猴桃中具有相似的功能。
我们进行了功能基因组学分析,以验证我们的预测是否有效。在植物中,在原花青素生物合成的最后一步,儿茶素和表儿茶素分别由白矢车菊素和矢车菊素转化而来。白矢车菊素到儿茶素的转化,矢车菊素到表儿茶素的转变,是由LAR或ANR催化的(图4a)。因此,为了验证AcMYB90、AcMYB111和AcMYB123-2在原花青素代谢调节中的作用,我们在烟草原生质体中进行了双荧光素酶实验。基于猕猴桃基因组,我们分离出六个LAR和ANR基因的启动子,并将其克隆到LUC报告基因表达载体中,包括proAcANR1::LUC,proAcANR2::LUC,proAcANR3::LUC,proAcLAR2::LUC,proAcLAR3::LUC和proAcLAR4::LUC。我们还生成了35S::AcMYB90,35S::AcMYB111和35S::AcMYB123-2,以表达作为效应物的3个TFs。在共转染原生质体后,我们发现AcMYB111不能激活ANR或LAR基因的启动子,而AcMYB90和AcMYB123-2增强了AcLAR3或AcLAR2启动子的活性(图4e;图S5)。由于AcMYB123-2对AcLAR2启动子的作用比AcMYB90对AcLAR3启动子的作用更强,我们将重点放在AcMYB123-2上,进行了进一步的功能研究。基于凝胶迁移(EMSA)实验,我们发现AcMYB123-2可以与依赖于Myb-p结合基序“CCWACC”的AcLAR2启动子直接互用(图4f)。此外,我们分析了过表达或沉默AcMYB123-2如何影响猕猴桃中原花青素的积累。我们使用含有35S::AcMYB123-2的根癌农杆菌GV3101用于AcMYB123-2的过表达,和基因沉默(VIGS)载体pTRV2::AcMYB123-2用于AcMYB123-2敲除。我们对120 DPA的猕猴桃果实进行农杆菌注射,并在农杆菌注射后7天采集样本。RT-qPCR分析表明,在AcMYB123-2瞬时过表达的猕猴桃中,AcLAR2的转录水平显著上调。相反,AcMYB123-2敲除猕猴桃中的AcLAR2下调。与对照相比,在AcMYB123-2过度表达的猕猴桃中,原花青素B/C积累更多,但在AcMYB223-2沉默的猕猴桃中,积累更少(图4g)。我们的体外和体内功能验证表明,AcMYB123-2直接转录调节关键结构基因AcLAR2的表达,参与调控猕猴桃原花青素代谢。
基于KMRN分析预测得到的调节PA代谢的TF家族,除了MYB之外,AP2/ERF是其中的另一个TF(图S4)。为了验证AP2/ERF转录因子是否能调节猕猴桃中的PA代谢,我们从原花青素MRN(图S4)中提取了AP2/ERF相关的子网络(图5a)。在AP2/ERF成员中,基于(1)AcERF192的表达与原花青素B2积累模式之间的密切相关性(数据集S10),以及(2)AcERF192与AtRAP2.5和AtERF8的同源性(AtRAP2.5与AtERF8参与调节拟南芥花青素生物合成)(图5b),我们选择了AcERF192进行研究。与AcMYB123-2结果一致,AcERF192激活了AcANR1的启动子(图5c),并直接与AcANR1启动子中的GCC-box结合(图5d)。此外,过表达和沉默实验表明,AcERF192调节AcANR1的转录,从而影响猕猴桃中原花青素B和原花青素C的生物合成(图5e)。
总之,我们揭示了原花青素的“MM vs GM”和MRNs的对比,以及两种关键转录因子AcMYB123-2和AcERF192在猕猴桃PA代谢的转录调节中的作用。
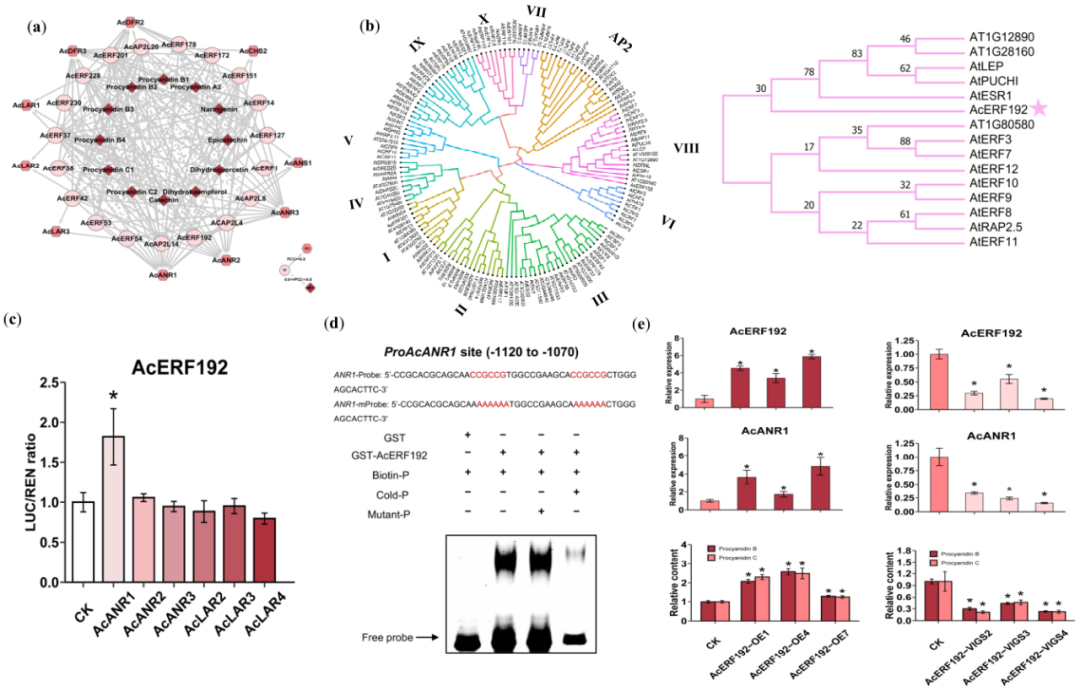
图5 转录因子AcERF192通过转录调节猕猴桃中的AcANR1来调节原花青素的积累。(a)原花青素MRN中AP2/ERF相关子网络。(b)拟南芥和猕猴桃AP2/ERF转录因子的系统发育树。I-X,AP2代表拟南芥中11个类别的ERF亚家族。(c)AcERF192的双荧光素酶报告基因测定。数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。(d)AcERF192与AcANR1启动子中的DRE/CRT元件结合。生物素探针(Biotin-p)、冷探针(Cold-p)和DRE/CRT元件突变探针(Mutant-p)在EMSA实验中被使用。符号–和+表示探针和GST-标记的AcERF192蛋白的缺失或存在。(e)过表达或沉默AcERF192的猕猴桃中AcERF192和AcANR1的相对mRNA水平,以及原花青素B和原花青素C的相对含量。(c)和(e)中的数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。
6. 猕猴桃中参与L-抗坏血酸代谢的循环途径
利用于上述研究相同的生物信息学和功能基因组学策略,我们试图揭示L-抗坏血酸(AsA)的代谢调节机制,这是猕猴桃的一个基本营养品质特征。我们分析了高等植物中的两种最重要的AsA生物合成途径,D-甘露糖/L-半乳糖途径和半乳糖醛酸途径。这两种途径都涉及由L-半乳糖内酯脱氢酶(GLDH)催化产生AsA的这一步(图6a)。在KMRN中,我们检测到AsA生物合成途径中的四种代谢物,包括D-果糖-6-磷酸、D-葡萄糖-6-磷酸、D-半乳糖醛酸和L-抗坏血酸(图6a)。然而,我们注意到,在猕猴桃的不同发育和成熟阶段,L-抗坏血酸和其他三种代谢物的积累模式不同(图6b;数据集S11)。
L-抗坏血酸聚集在MM-VI中。在25 DPA时,L-抗坏血酸积累到最高的水平,在之后的猕猴桃发育和成熟过程中,其水平逐渐下降(图6b;数据集S11)。在10 DPA时,我们也发现,L-抗坏血酸的积累和AsA生物合成基因的表达模式是相反的。大多数AsA生物合成基因,包括两个关键结构基因AcGME2和AcGGP3,都聚集在GM-II中,而不是GM-VI中(图6b)。针对这种相互矛盾的“MM vs GM”趋势,我们进一步分析了AsA循环途径(图6a)。该途径包含L-抗坏血酸过氧化物酶(APX)和L-抗坏血酸氧化酶(AO),它们可以将L-抗坏血酸氧化为L-单/脱氢抗坏血酸。在10 DPA时,L-脱氢抗坏血酸显示出最高的积累,与AcAO1和AcAPX2的表达一致(图6b)。AcAO1的转录水平在10 DPA时比25 DPA高10倍左右(图S6)。这些分析表明,L-抗坏血酸的降解是由循环途径中的关键结构基因介导的,这可能是L-抗坏血酸在10 DPA时积累较少的原因。
为了验证这一假设,我们将35S::AcAO1和35S::AcAPX2注射到烟草叶片中。LC-MS分析表明,与对照相比,AcAO1、AcAPX2的过表达显著降低了叶片中的L-抗坏血酸和总AsAs(L-抗坏血酸和L-脱氢抗坏血酸)的含量(图S6)。此外,在120 DPA时,猕猴桃中AcAO1的过表达和pTRV2::AcAO1介导的VIGS分别导致AsA和总AsA含量显著变化(图6c)。总之,这些结果表明,AsA循环途径介导了L-抗坏血酸的积累。
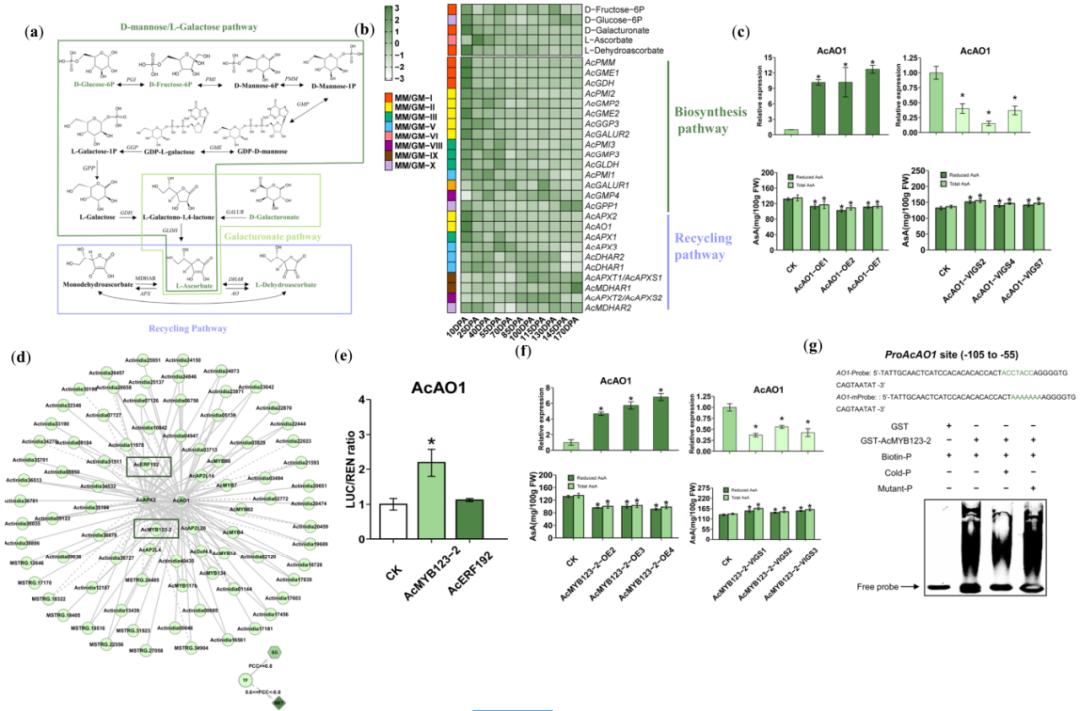
图6 转录因子AcMYB123-2通过调节猕猴桃中的AcAO1来调节维生素C(L-抗坏血酸,AsA)的降解。(a)AsA代谢途径。颜色(#508548)表示在KMRN中检测到的代谢物。D-甘露糖/L-半乳糖和半乳糖醛酸途径是植物中最重要的两种维生素生物合成途径。循环途径是AsA循环途径。PGI,葡萄糖-6-磷酸异构酶;PMI,甘露醇-6-磷酸异构酶;PMM,磷酸甘露聚糖酶;GMP,甘露糖-1-磷酸鸟苷酸转移酶;GME,GDP-D-甘露糖3',5'-表异构酶;GGP,GDP-L-半乳糖磷酸化酶;GPP,L-半乳糖1-磷酸磷酸酶;GDH,L-半乳糖脱氢酶;GLDH,L-半乳糖-1,4-内酯脱氢酶;GALUR,D-半乳糖醛酸还原酶;MDHAR,单脱氢抗坏血酸还原酶;DHAR,L-抗坏血酸还原酶;APX,L-抗坏血酸过氧化物酶;AO,L-抗坏血酸氧化酶。(b)AsA途径中代谢物和基因的热图。数据的Z-值标准化为-3至3。颜色(#508548)和(#9398FF)分别对应于AsA生物合成和循环途径中的基因。(c)AcAO1-过表达或沉默的猕猴桃中AcAO1的相对mRNA水平,以及AsA(L-抗坏血酸)和总AsA(L-抗坏血酸+L-脱氢抗坏血酸)的含量。FW,鲜重。(d)AsA-MRN中的AcAO1和AcAPX2。(e)双荧光素酶报告基因测定AcMYB123-2对AcAO1启动子的激活。数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。(f)AcMYB123-2过表达和沉默猕猴桃中的AcAO1相对mRNA水平,以及AsA和总AsA的含量。FW,鲜重。(g)AcMYB123-2与AcAO1启动子中的Myb-p基序结合。生物素探针(Biotin-p)、冷探针(Cold-p)和Myb-p元件突变探针(Mutant-p)在EMSA实验中被使用。符号–和+表示探针和GST-标记的AcMYB123-2蛋白的缺失或存在。(c)、(e)和(f)中的数据表示为平均值±标准差(n=3)。星号表示Student’s t-检验具有统计学意义(P<0.05)。
7. 调控AsA循环途径的新转录因子
为了进一步了解AsA循环途径的调控因素,我们在KMRN中筛选了假定的TFs,并生成了GM-II中AcAO1和AcAPX2的调控网络(图6d;数据集S11)。在AcAO1和AcAPX2调节网络中(图6d;数据集S11),我们也发现了原花青素MRN中出现的AcMYB123-2和AcERF192(图4c;图5a)。为了检验这两种TFs是否直接调节AcAO1的转录而参与猕猴桃的AsA代谢,我们在双荧光素酶实验中验证了AcMYB123-2和AcERF192如何影响AcAO1的启动子活性。我们发现,只有AcMYB123-2可以激活AcAO1的启动子(图6e)。我们开展了相同的实验来研究PA代谢(图4g),与对照相比,AcMYB123-2过表达猕猴桃中的AsA和总AsA含量显著降低。此外,AcMYB123-2过表达猕猴桃中,AcAO1的转录水平较高,但在AcMYB123-2沉默猕猴桃中,AcAO1的转录水平较低(图6f)。此外,EMSA实验进一步表明,AcMYB123-2可以结合AcAO1启动子中的Myb-p结合位点(CCWACC)(图6g)。总之,这些结果表明,转录因子AcMYB123-2直接结合AcAO1的启动子区域来调控AsA循环途径,从而影响AcAO1的转录。
讨论
解析果实风味和果实营养的关键化合物的代谢途径,并揭示其潜在的转录组和转录调控网络,是通过分子育种提高果实品质的两个重要步骤。至今,通过先进的代谢物检测技术,研究者已经鉴定出许多与果实品质有关的化合物,但是这些化合物的代谢途径及其潜在的调控网络在很大程度上仍不清楚。本研究中,我们对猕猴桃的11个发育和成熟阶段的代谢组和转录组数据进行了综合分析,揭示了代谢与基因模块的动态变化,构建了高分辨率的猕猴桃代谢调节网络(KMRN)。将该网络与体外、体内基因功能实验相结合,我们不仅在已知的代谢途径中验证了MMs vs GMs,还鉴定了新的调节因子并阐明了潜在的调节机制。
在不同植物中,代谢组和转录组联合分析已成为生成代谢调节网络(MRNs)的有力手段。使用该策略,在猕猴桃果实发育和成熟过程中,我们已经建立了初级KMRN,并揭示了涉及关键TFs的调节机制,以调节风味(可溶性糖、有机酸和重要挥发物)的代谢。在本研究中,我们进一步分析了初级KMRN,并鉴定了调节重要代谢物(PAs和维生素C)积累的新TFs。通过这两项研究,我们在猕猴桃中构建了初级(风味)和次级(营养)MRNs,为设计分子育种提供了丰富的资源,以增强和改善猕猴桃的风味和营养(图7)。
花青素和PAs都是类黄酮代谢途径的产物。对于花青素,之前的研究表明,花青素在85DPA时开始积累,并在猕猴桃发育后期逐渐增加,这与我们的大多数的代谢数据一致(图7;图S3)。同时,AdMYB10/75/110、AcMYB123、AcF3'H1和F3GT1在内的多个基因被鉴定,它们调节着猕猴桃中花青素的积累(图7)。然而,在猕猴桃发育过程中,PAs的变化及其潜在的调控机制研究较少。在拟南芥中,PAs在种皮中积累。这与柿子、草莓和葡萄等肉质水果中PA生物合成不同,PA积累通常发生在肉质果实的早期发育阶段。我们发现PAs优先在10DPA积累,并且编码PA生物合成途径中关键酶的基因,如LARs和ANRs,在猕猴桃的同一发育阶段高度表达(图4b;图7)。这些工作表明,PAs在果树中存在保守的积累模式。由于PAs在保护植物免受食草动物和疾病的侵害方面发挥着重要作用,PAs的早期积累也可能与猕猴桃早期发育过程中的这种防御作用有关。
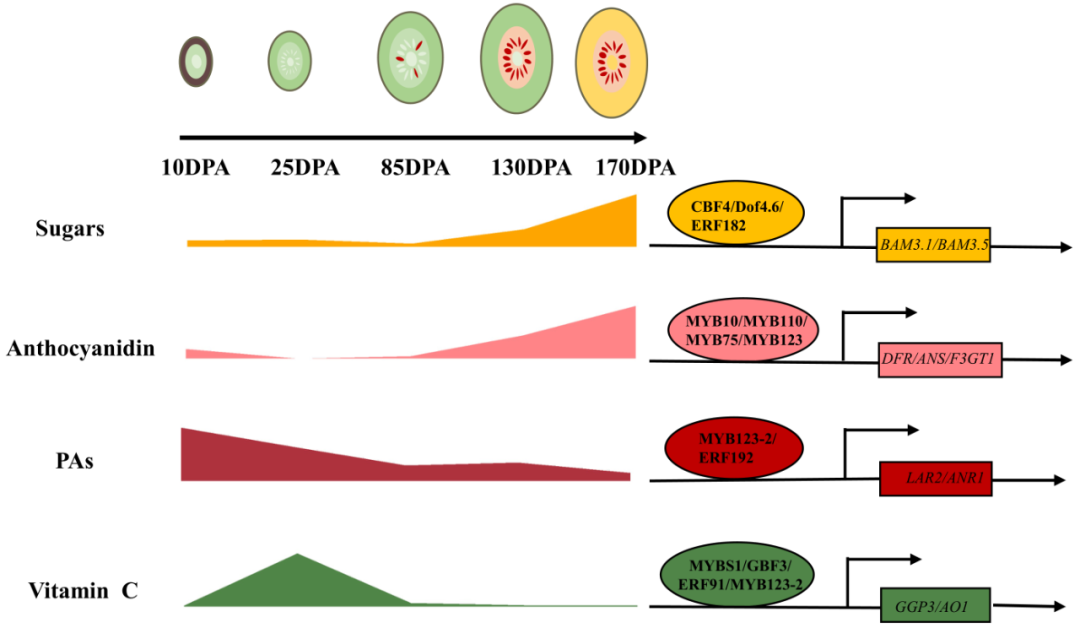
图7 示意图为猕猴桃品质形成过程中主要代谢物的动态变化及其调控机制。DPA,开花后的天数。猕猴桃不同发育阶段的代谢物含量标准化为0-1。椭圆代表转录因子,矩形代表转录调控模式中的结构基因。
R2R3型MYB转录因子已经被证明是不同植物中PA生物合成调控的关键调节因子。我们发现了一种新的R2R3型AcMYB123-2,与AtTT2和VvMYBPA2同源,通过直接激活PA生物合成中关键基因AcLAR2的转录,在猕猴桃的PA代谢中发挥重要作用。这些结果表明,R2R3型MYB在不同的植物中具有保守的功能。除了AcMYB123-2,我们还鉴定了一种ERF型转录因子AcERF192,它在PA代谢中起着关键的调节作用(图7)。ERF在花青素积累中的作用在很多植物中均有报道,但是在果树中,ERF参与原花青素生物合成的途径仍不清楚。本研究增加了我们对植物中PA和类黄酮代谢调控的理解。
D-甘露糖/L-半乳糖途径被认为是植物中AsA生物合成的主要途径。在本研究中,我们发现,在猕猴桃发育和成熟过程中,AO和APX介导的循环途径在L-抗坏血酸积累中也起着重要作用。这个结论得到了以下支持,在10DPA后的果实中,高AO和APX转录与L-抗坏血酸的低含量有关,在25DPA后的果实中,AO和APX的mRNA急剧减少解释了L-抗坏血酸的高积累(图6b;图7)。与我们的结果一致,在番茄中,AO的表达水平与L-抗坏血酸的积累呈负相关。尽管在不同的植物中已经鉴定出同源的AO基因,但研究者在转录水平上对AOs的调节仍不清楚。与之前关注的L-抗坏血酸生物合成途径的研究不同,我们建立了AcAO1的调控网络,并揭示了AcMYB123-2通过与AcAO1的启动子直接结合来控制AcAO1的转录(图7)。因此,在猕猴桃发育过程中,我们的研究为L-抗坏血酸代谢调节提供了新的见解。在猕猴桃发育过程中,AcMYB123-2作为PA和AsA代谢的关键调节因子,表明该转录因子可以同时调节两种代谢途径。我们认为,AcMYB123-2作为一种有用的遗传资源,可以用于生物技术改良,有助于改善猕猴桃品质的多种性状。最近的研究表明,操纵单一转录因子可以同时影响果实中不同生物合成途径的营养或风味相关代谢物。
在目前的研究中,我们发现了大量的代谢物。然而,由于广泛靶向LC-MS/MS的检测极限,部分代谢物,如类胡萝卜素和酯类等没有定量。因此,可能需要更高分辨率的代谢组来揭示新的化合物的积累模式,在未来,还需要构建更全面的代谢调控途径。贯穿猕猴桃果实的整个生长周期,本研究中描述的代谢组、转录组,以及代谢组和转录组的共表达分析,为广泛研究KMRN提供了丰富、准确和稳健的资源。
结论
在猕猴桃11个果实发育和成熟阶段,我们的研究产生了高分辨率的代谢组和转录组信息。KMRN全面概述了猕猴桃发育和成熟过程中发生的主要代谢变化,以及支撑这些代谢变化的转录组和转录调控机制。结合功能基因组分析并挖掘KMRN,可以揭示调控猕猴桃主要代谢物的机制,并指导改良果实品质的工作。本研究的KMRN和基因功能分析的实验策略,将有助于发现和验证猕猴桃中其他MM vs GM的调控机制,并为其他果实的相似工作制定蓝图和提供借鉴。
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18840